- Müəllif Alex Aldridge [email protected].
- Public 2023-12-17 13:32.
- Son dəyişdirildi 2025-06-01 07:36.
Birinci və ikinci dərəcəli reaksiyalar arasındakı əsas fərq ondan ibarətdir ki, birinci dərəcəli reaksiyaların sürəti sürət tənliyində reaktiv konsentrasiyanın birinci gücündən, ikinci dərəcəli reaksiyaların sürəti isə konsentrasiyanın ikinci gücündən asılıdır. dərəcə tənliyində müddətli.
Reaksiya sırası sürət qanunu tənliyində reaksiyaya girən maddələrin konsentrasiyalarının artırıldığı güclərin cəmidir. Bu tərifə görə reaksiyaların bir neçə forması var; sıfır dərəcəli reaksiyalar (bu reaksiyalar reaktivlərin konsentrasiyasından asılı deyil), birinci dərəcəli reaksiyalar və ikinci dərəcəli reaksiyalar.
Birinci Sifariş Reaksiyaları nədir?
Birinci dərəcəli reaksiyalar kimyəvi reaksiyalardır ki, onların reaksiya sürəti reaksiyada iştirak edən reaktivlərdən birinin molar konsentrasiyasından asılıdır. Buna görə də, reaksiya qaydası üçün yuxarıda verilmiş tərifə əsasən, sürət qanunu tənliyində reaksiyaya girən maddələrin konsentrasiyalarının artırıldığı güclərin cəmi həmişə 1 olacaqdır. Bu reaksiyalarda iştirak edən ya tək reaktiv ola bilər. Sonra həmin reaktivin konsentrasiyası reaksiyanın sürətini təyin edir. Lakin bəzən bu reaksiyalarda birdən çox reaktiv iştirak edir, onda bu reaktivlərdən biri reaksiyanın sürətini təyin edəcək.
Bu anlayışı başa düşmək üçün bir nümunə nəzərdən keçirək. N2O5 parçalanma reaksiyasında NO2 və O əmələ gətirir. Məhsul kimi 2 qazlar. Yalnız bir reaktiv olduğundan, reaksiyanı və sürət tənliyini aşağıdakı kimi yaza bilərik.
2N2O5(g) → 4NO2(g) + O 2(g)
Qiymət=k[N2O5(g)]m
Burada k bu reaksiyanın sürət sabiti, m isə reaksiyanın ardıcıllığıdır. Buna görə də, eksperimental təyinatlardan m dəyəri 1-dir. Beləliklə, bu, birinci dərəcəli reaksiyadır.
İkinci Sıra Reaksiyalar nədir?
İkinci dərəcəli reaksiyalar kimyəvi reaksiyalardır ki, onların reaksiya sürəti reaktivlərdən ikisinin molar konsentrasiyasından və ya reaksiyada iştirak edən bir reaktivin ikinci gücündən asılıdır. Buna görə də, reaksiya qaydası üçün yuxarıda verilmiş tərifə əsasən, sürət qanunu tənliyində reaktiv konsentrasiyalarının yüksəldildiyi güclərin cəmi həmişə 2 olacaqdır. Əgər iki reaktiv varsa, reaksiya sürəti birinci gücdən asılı olacaq. hər bir reaktivin konsentrasiyası.
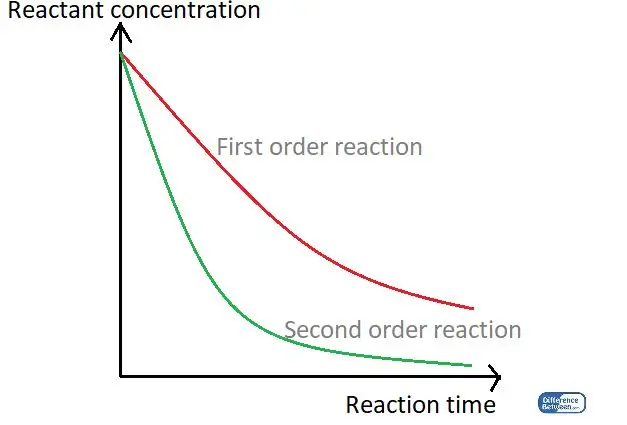
Şəkil 01: Reaksiya müddətindən və reaktiv konsentrasiyadan istifadə edərək iki növ reaksiya növünü müqayisə edən qrafik.
Əgər reaktivin konsentrasiyasını 2 dəfə artırsaq (tezlik tənliyində iki reaktiv varsa), onda reaksiyanın sürəti 4 dəfə artır. Məsələn, aşağıdakı reaksiyanı nəzərdən keçirək.
2A → P
Burada A reaktiv, P isə məhsuldur. Əgər bu ikinci dərəcəli reaksiyadırsa, bu reaksiyanın sürət tənliyi aşağıdakı kimidir.
Qiymət=k[A]2
Ancaq aşağıdakı kimi iki fərqli reaktivlə reaksiya üçün;
A + B → P
Qiymət=k[A]1[B]1
Birinci və ikinci dərəcəli reaksiyalar arasındakı fərq nədir?
Birinci dərəcəli reaksiyalar kimyəvi reaksiyalardır ki, onların reaksiya sürəti reaksiyada iştirak edən reaktivlərdən birinin molar konsentrasiyasından asılıdır. Deməli, reaksiyaya girən maddənin konsentrasiyasını 2 dəfə artırsaq, reaksiyanın sürəti 2 dəfə artır. İkinci dərəcəli reaksiyalar, reaksiya sürəti reaktivlərdən ikisinin molar konsentrasiyasından və ya reaksiyada iştirak edən bir reaktivin ikinci gücündən asılı olan kimyəvi reaksiyalardır. Deməli, reaktivin konsentrasiyasını 2 dəfə artırsaq, reaksiyanın sürəti 4 dəfə artır. Aşağıdakı infoqrafika birinci və ikinci dərəcəli reaksiyalar arasındakı fərqi cədvəl şəklində təqdim edir.

Xülasə - Birinci və İkinci Sıra Reaksiyaları
Reaksiya sırasına görə üç əsas reaksiya növü var; sıfır, birinci və ikinci dərəcəli reaksiyalar. Birinci və ikinci dərəcəli reaksiyalar arasındakı əsas fərq ondan ibarətdir ki, birinci dərəcəli reaksiyanın sürəti sürət tənliyində reaktiv konsentrasiyanın birinci gücündən asılıdır, ikinci dərəcəli reaksiyanın sürəti isə konsentrasiya müddətinin ikinci gücündən asılıdır. dərəcə tənliyi.






