- Müəllif Alex Aldridge [email protected].
- Public 2023-12-17 13:32.
- Son dəyişdirildi 2025-06-01 07:36.
Əsas Fərq - Güclü Liqa vs Zəif Liqa
Liqand mərkəzi atom və ya ion ilə koordinat kovalent bağ vasitəsilə iki elektronunu bağışlayan və ya paylaşan atom, ion və ya molekuldur. Liqandlar anlayışı koordinasiya kimyası altında müzakirə olunur. Liqandlar metal ionları ilə komplekslərin əmələ gəlməsində iştirak edən kimyəvi növlərdir. Beləliklə, onlar həm də kompleksləşdirici maddələr kimi tanınırlar. Liqandlar liqandın sıxlığına görə monodentat, iki dişli, üç dişli və s. ola bilər. Denticity bir liqandda mövcud olan donor qruplarının sayıdır. Monodentat liqandın yalnız bir donor qrupuna sahib olması deməkdir. Bidentat, bir ligand molekulu üçün iki donor qrupuna sahib olduğunu bildirir. Kristal sahə nəzəriyyəsinə əsasən təsnif edilən iki əsas liqand növü var; güclü liqandlar (və ya güclü sahə liqandları) və zəif liqandlar (və ya zəif sahə liqandları). Güclü ligandlar və zəif liqandlar arasındakı əsas fərq, güclü bir sahə ligandına bağlandıqdan sonra orbitalların parçalanması daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha yüksək fərqə səbəb olur, zəif bir sahə ligandına bağlandıqdan sonra orbitalların parçalanması isə daha az fərqə səbəb olur. daha yüksək və aşağı enerji səviyyəli orbitallar arasında.
Kristal Sahə Nəzəriyyəsi nədir?
Kristal sahəsi nəzəriyyəsi ətraf mühitin yaratdığı statik elektrik sahəsinə görə elektron orbitallarının (adətən d və ya f orbitallarının) degenerasiyalarının (bərabər enerjili elektron qabıqlarının) qırılmasını izah etmək üçün nəzərdə tutulmuş model kimi təsvir edilə bilər. anion və ya anionlar (və ya liqandlar). Bu nəzəriyyə tez-tez keçid metal ionları komplekslərinin davranışını nümayiş etdirmək üçün istifadə olunur. Bu nəzəriyyə maqnit xüsusiyyətlərini, koordinasiya komplekslərinin rənglərini, hidratasiya entalpiyalarını və s.
Nəzəriyyə:
Metal ionu ilə liqandlar arasındakı qarşılıqlı təsir müsbət yüklü metal ionu ilə liqandın qoşalaşmamış elektronlarının mənfi yükü arasındakı cazibənin nəticəsidir. Bu nəzəriyyə əsasən beş degenerasiya olunmuş elektron orbitalında baş verən dəyişikliklərə əsaslanır (metal atomunda beş d orbital var). Bir liqand metal ionuna yaxınlaşdıqda, qoşalaşmamış elektronlar bəzi d orbitallarına metal ionunun digər d orbitallarına nisbətən daha yaxın olurlar. Bu, degenerasiya itkisinə səbəb olur. Həmçinin, d orbitallarındakı elektronlar liqandın elektronlarını itələyir (çünki hər ikisi mənfi yüklüdür). Deməli, liqandaya daha yaxın olan d orbitalları digər d orbitallarından daha yüksək enerjiyə malikdir. Bu, enerjiyə əsaslanaraq d orbitallarının yüksək enerjili d orbitallarına və aşağı enerjili d orbitallarına parçalanması ilə nəticələnir.
Bu bölünməyə təsir edən bəzi amillər; metal ionunun təbiəti, metal ionunun oksidləşmə vəziyyəti, liqandların mərkəzi metal ionu ətrafında düzülüşü və liqandların təbiəti. Bu d orbitalların enerji əsasında parçalanmasından sonra yüksək və aşağı enerjili d orbitalları arasındakı fərq kristal sahənin parçalanma parametri kimi tanınır (oktaedral komplekslər üçün ∆oct).
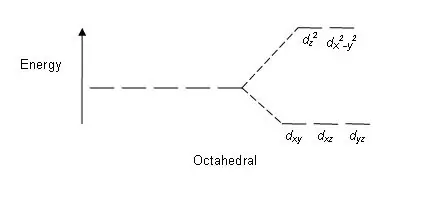
Şəkil 01: Oktaedral Komplekslərdə Bölmə Nümunəsi
Parçalanma nümunəsi: Beş d orbital olduğundan, parçalanma 2:3 nisbətində baş verir. Oktaedral komplekslərdə iki orbital yüksək enerji səviyyəsindədir (birlikdə "məs." kimi tanınır), üç orbital isə aşağı enerji səviyyəsindədir (birlikdə t2g kimi tanınır). Tetrahedral komplekslərdə bunun əksi baş verir; üç orbital daha yüksək enerji səviyyəsində, ikisi isə aşağı enerji səviyyəsindədir.
Strong Ligand nədir?
Güclü liqand və ya güclü sahə liqandı daha yüksək kristal sahəsinin parçalanması ilə nəticələnə bilən liqanddır. Bu o deməkdir ki, güclü sahə liqandının bağlanması daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha yüksək fərqə səbəb olur. Nümunələrə CN- (sianid liqandları), NO2- (nitroliqand) və CO (karbonil) daxildir. liqandlar).
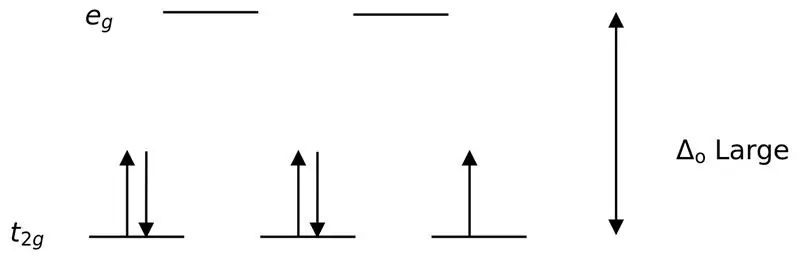
Şəkil 02: Aşağı Spin Parçalanması
Bu liqandlarla komplekslərin əmələ gəlməsində əvvəlcə aşağı enerjili orbitallar (t2g) hər hansı digər yüksək enerji səviyyəli orbitallara (məs.) doldurulmazdan əvvəl tamamilə elektronlarla doldurulur. Bu şəkildə əmələ gələn komplekslər “aşağı spin kompleksləri” adlanır.
Zəif Liqand nədir?
Zəif liqand və ya zəif sahə liqandı daha aşağı kristal sahənin parçalanması ilə nəticələnə bilən liqanddır. Bu o deməkdir ki, zəif sahə liqandının bağlanması daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha az fərqə səbəb olur.
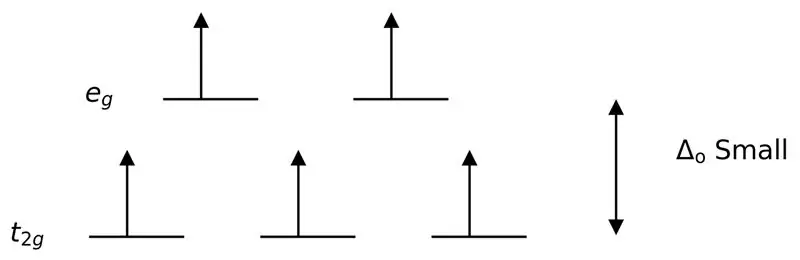
Şəkil 3: Yüksək Spin Parçalanması
Bu halda, iki orbital səviyyə arasındakı aşağı fərq həmin enerji səviyyələrində elektronlar arasında itələmələrə səbəb olduğundan, aşağı enerjili orbitallarla müqayisədə daha yüksək enerjili orbitallar asanlıqla elektronlarla doldurula bilər. Bu liqandlarla əmələ gələn komplekslərə “yüksək spinli komplekslər” deyilir. Zəif sahə liqandlarına misal olaraq I- (iyodid liqand), Br- (bromid liqand) və s. daxildir.
Güclü Liqand və Zəif Liqand Arasındakı Fərq Nədir?
Güclü Liqa vs Zəif Liqa |
|
| Güclü liqand və ya güclü sahə liqandı daha yüksək kristal sahəsinin parçalanması ilə nəticələnə bilən liqanddır. | Zəif liqand və ya zəif sahə liqandı daha aşağı kristal sahənin parçalanması ilə nəticələnə bilən liqanddır. |
| Nəzəriyyə | |
| Güclü sahə liqandını bağladıqdan sonra parçalanma daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha yüksək fərqə səbəb olur. | Zəif sahə liqandını bağladıqdan sonra orbitalların parçalanması daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha az fərqə səbəb olur. |
| Kateqoriya | |
| Güclü sahə liqandları ilə əmələ gələn komplekslər "aşağı spin kompleksləri" adlanır. | Zəif sahə liqandları ilə əmələ gələn komplekslər "yüksək spin kompleksləri" adlanır. |
Xülasə - Güclü Liqa vs Zəif Liqa
Güclü liqandlar və zəif liqandlar metal ionunun d orbitallarının iki enerji səviyyəsinə parçalanmasına səbəb olan anionlar və ya molekullardır. Güclü ligandlar və zəif liqandlar arasındakı fərq, güclü sahə ligandını bağladıqdan sonra parçalanmanın daha yüksək və aşağı enerji səviyyəli orbitallar arasında daha yüksək fərqə səbəb olmasıdır, zəif sahə ligandını bağladıqdan sonra orbitalların parçalanması isə daha yüksək və aşağı olanlar arasında daha az fərqə səbəb olur. enerji səviyyəli orbitallar.






